Популяционно-генетические биобанки – сохраняемые в течение многих лет коллекции детально аннотированного биологического материала – ценный ресурс фундаментальной и прикладной науки, необходимый для полноценного анализа генофонда. Фундаментальной науке биобанки позволяют исследовать генетическую структуру популяций и реконструировать их генетическую историю. Не меньше их значение для решения практических задач: без популяционных биобанков невозможно развитие персонализированной медицины, они обеспечивают эколого-генетический мониторинг популяций и востребованы в судебно-медицинской экспертизе. Создание качественного и репрезентативного биобанка основано на строгом соблюдении принципов отбора образцов в популяциях, протоколов выделения ДНК, контроля ее качества, хранения и каталогизации биологических образцов. На примере Биобанка народонаселения Северной Евразии, созданного под руководством Е.В. Балановской и О.П. Балановского и содержащего на начало 2016 г. более 25500 образцов из 274 популяций, описана стратегия формирования популяционно-генетических биобанков и дан обзор региональных биобанков. Приведен опыт использования биобанков в междисциплинарных исследованиях, показаны конкретные результаты и перспективные направления реализации этого ресурса для целей геногеографии, геномной медицины и криминалистики.
Задача создания биобанков “всего живого” не только уже осознается научным сообществом как необходимость, но и начинает реализовываться. На первый план выходят проблемы правильной организации биобанка – любая ошибка или непродуманность, допущенная при закладке биобанка, резко сузит возможности его применения в будущем. Поэтому важно широкое обсуждение технологии создания самых разных биобанков. Зачастую проблемы, с которыми сталкиваются их разработчики, являются общими, и обсуждение помогает не наступать на те грабли, которые коллеги на горьком опыте научились обходить. Наш коллектив имеет почти двадцатилетний опыт создания крупнейшего в мире популяционного биобанка о коренном народонаселении Северной Евразии и мы надеемся, что описание принципов и способов его реализации, представленное в этой статье, будет полезно и исследователям, работающим с другими объектами.
Биобанки – это специализированные долговременные хранилища детально аннотированных биологических материалов. Как разновидность биорепозитория, они нацелены не столько на сбор биологических материалов, сколько на систематизацию и анализ данных для решения научных и медицинских задач. Биорепозитории существуют в различных формах уже более 150 лет [1], например, отечественная коллекция Зоологического института РАН [2]. В эпоху технологического прогресса в биологии они получили новый импульс [3-5]. Так, известный журнал Time определил биобанкинг как одну из “десятка идей, которые могут изменить мир прямо сейчас” [6]. В мире зарегистрировано более 120 крупных исследовательских биобанков, а коммерческих биобанков только в Европе более 500. Для регулирования их работы созданы организации ISBER и ESBB. Развитие биобанкинга можно подразделить на три этапа: 1) 1980-1990-е годы – основное внимание уделяется количеству образцов; 2) 2000-е – акцент смещается на качество образцов и их детальную характеристику; 3) современные биобанки – акцент на количество, качество, характеристику образцов и непосредственное вовлечение заинтересованных участников [7].
При создании современных биобанков параллельно решаются три задачи. Во-первых, правильной организации сбора образцов. Во-вторых, сохранения на многие годы их “работоспособности”. Третья задача – детального описания происхождения образцов – пожалуй, самая важная. Как шутят на своих конференциях зарубежные специалисты по биобанкингу, биобанк без подробной характеристики доноров образцов – это “мусорбанк”. Только тщательная система описания образцов и их доноров позволяет превратить склад образцов в биобанк.
Наиболее популярным объектом биобанков является, конечно, человек, для которого создаются два основных типа биобанков: образцов пациентов (медицинские биобанки) и образцов обычных людей (популяционные биобанки).
Биобанки первого типа хранят образцы, связанные с определенным медицинским диагнозом. В основном это коммерческие биобанки, осуществляющие аутсортинговую деятельность для фармацевтических и биотехнологических компаний [7]. Они нацелены на решение медицинских задач – поиска связи генов с заболеваниями, биомаркеров болезней, мишеней для лекарств [8, 9], а фундаментальные исследования составляют незначительный процент. Например, Biobank of Graz (Австрия), входящий в сеть биобанков Европы (The European Biobanking), Biomolecular Resource Research Infrastructure (BBMRI-ERIC) и его аналог National Austrian BBMRI.AT. UK Biobank считается важным национальным ресурсом в области здравоохранения и включает образцы от 500 тыс. человек. Испанский национальный биобанк учрежден в 2004 г. для исследований генетического разнообразия, факторов предрасположенности к заболеваниям и разработки персонализированной медицины.
Биобанки второго типа – популяционные – хранят биологический материал, собранный в группах населения, не ассоциированных с тем или иным заболеванием. Они служат и медицине – например, для формирования контрольной выборки [10], но чаще используются популяционной генетикой для анализа генофонда [11, 12]. Популяционные биобанки нацелены на решение задач фундаментальной науки – выявить пласты генофонда различной древности [13-19], пути миграций [20, 21], интенсивность ассимиляции, эффекты дрейфа генов и естественного отбора [22-24]. Результаты служат междисциплинарным исследованиям путей формирования разных групп населения.
Но применение популяционных биобанков не ограничивается сферой фундаментальной науки: популяционная генетика накапливает данные и о генетических маркерах, ассоциированных с заболеваниями, об их частоте в разных популяциях [25]. По мере развития персонализированной и геномной медицины популяционно-генетические исследования начинают играть все более важную роль в сфере здравоохранения [26-28]. Растет роль популяционных биобанков и в другом практическом приложении – криминалистике, обеспечивая решение двух задач: определение этногеографического происхождения по ДНК и референсные базы данных для расчета степени достоверности ДНК-идентификации [29-31].
Как долговременное хранилище образцов популяционные биобанки имеют еще одно непреходящее значение: они сохраняют информацию о генетическом разнообразии человечества в век глобализма, когда генофонды многих малых народов исчезают с лица земли или же утрачивают свой древний генофонд, перекрываясь современными потоками генов.
Итак, популяционные биобанки, хранящие в течение многих лет тщательно аннотированные коллекции биологического материала, являются важнейшим инструментом в популяционно-генетических исследованиях, а их создание – необходимое условие для полноценного анализа генофондов, развития персонализированной медицины и других практических приложений.
Важнейшие требования к популяционному биобанку включают три аспекта:
а) качество и репрезентативность коллекций биологических материалов;
б) качество информации, сопровождающей каждый образец и всю выборку;
в) качество организации хранения образцов и информационных систем.
Увидеть, как реализуются эти требования, удобнее на конкретном примере. В России существует ряд популяционных биобанков. Наиболее известные из них (двигаясь с востока на запад страны): магаданский биобанк (руководители – д.б.н. Б.А. Малярчук и д.б.н. М.В. Деренко, Институт биологических проблем севера ДВО РАН), томский биобанк (руководитель – проф. В.А. Степанов, НИИ медицинской генетики СО РАН), новосибирский биобанк (руководитель – член-корр. РАН М.И. Воевода, НИИ терапии и профилактической медицины СО РАН), уфимский биобанк (руководитель – проф. Э.К. Хуснутдинова, Институт биохимии и генетики Уфимского научного центра РАН) и три московских (биобанк под руководством проф. С.А. Лимборской, Институт молекулярной генетики РАН; биобанк под руководством д.б.н. О.В. Жуковой, Институт общей генетики РАН; биобанк под руководством проф. Е.В. Балановской и проф. РАН О.П. Балановского).
Из них крупнейшим? является последний – Биобанк народонаселения Северной Евразии, созданный большим научным коллективом под руководством Е.В. и О.П. Балановских: научный коллектив включает сотрудников лаборатории популяционной генетики Медико-генетического научного центра РАН, лаборатории геномной географии Института общей генетики РАН и представителей целого ряда других организаций России и иных стран.
Биобанк народонаселения Северной Евразии
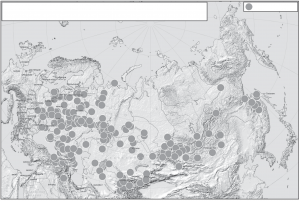
Рис.1 Карта популяций, представленных в Биобанке народонаселения Северной Евразии, созданного под руководством Е.В. Балановской и О.П. Балановского.
Биобанк народонаселения Северной Евразии основан в 1998 г. Большинство образцов было собрано в рамках международного проекта The Genographic project (2005-2011 гг.) и его второй фазы Genographic 2.0 (2012-2014) Исследовательским центром “Северная Евразия”, возглавлявшимся ведущими исследователями проекта Genographic Е.В. Балановской и О.П. Балановским. В 2014 г. решением руководства проекта Genographic собранные образцы были переданы указанным ведущим исследователям. Образцы Биобанка были собраны не только по проекту Genographic, но и по другим проектам под общим руководством Е.В. Балановской сообществом отдельных ученых из разных стран. Биобанк несколько лет существовал на общественных началах, а в 2016 г. был официально оформлен как Автономное некоммерческое учреждение “Биобанк народонаселения Северной Евразии”. Биобанк предназначен только для научного использования. Биобанк интенсивно пополняется в течение уже 18 лет, причем все образцы собраны по единой технологии – в ходе экспедиционных работ и в России, и в сопредельных странах. На момент подачи этой статьи Биобанк Северной Евразии включал более 25.5 тыс. образцов ДНК из 273 популяций, представляющих более 90 народов 17 стран – России, Абхазии, Армении, Азербайджана, Афганистана, Белоруссии, Грузии, Литвы, Казахстана, Киргизии, Молдовы, Монголии, Таджикистана, Турции, Узбекистана, Украины, Шри-Ланки (рис. 1). В том числе: 70 популяций из Восточной Европы, 55 популяций Кавказа, 6 популяций Крыма, 49 популяций Волго-Уральского региона, 43 популяции из Сибири и Дальнего Востока, 51 популяция из Центральной Азии. Народы с обширным ареалом или генетически гетерогенные представлены многими региональными выборками, например, башкиры – 24 популяциями; украинцы – 13 популяциями. Кроме этого, биобанк содержит выборки образцов однофамильцев [32] и выборки, собранные для исследования связи с различными заболеваниями [10]. Поэтому логично рассмотреть на примере именно этого крупнейшего биобанка как реализуются принципы создания и особенности использования популяционных биобанков.
Как устроен биобанк
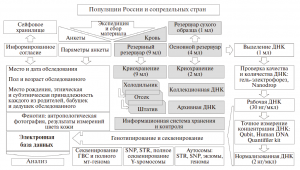
Образец одного индивида в Биобанке распределен по трем резервуарам с образцами крови и четырем резервуарам с ДНК различной концентрации [32] (рис. 2). Образцы крови собираются в экспедиции в “резервный” вакутейнер (9 мл) и “основной” вакутейнер (4 мл), из которого берется 1 мл крови для создания резервного сухого образца. Из “основного” вакутейнера берется еще 1 мл крови для выделения ДНК фенол-хлороформным методом: только этот метод гарантирует высокое качество и долговременное хранение ДНК. Оставшиеся 2 мл крови “основного” вакутейнера хранятся в криопробирках, которые размораживаются, когда требуется дополнительное выделение ДНК. Разные типы образцов хранятся при -80 и -40°C.
Выделенная ДНК распределяется по коллекциям с разной концентрацией – от оптимальной для полногеномного секвенирования до оптимальной для криминалистических наборов генотипирования (рис. 2).
После проверки качества и количества ДНК методами гель-электрофореза в агарозном геле, спектрофотометрии (Nanodrop 2000), флуориметрии (Qubit 2.0) и эффективной концентрации ДНК (определяемой методом ПЦР в реальном времени набором Human DNA Quantifiler Kit, Applied Biosystems) формируются четыре ДНК коллекции. Первая – “коллекционная ДНК” – содержит высококонцентрированную ДНК, хранится при температуре -80°C и предназначена для использования в долгосрочной перспективе. Поэтому часть коллекционной ДНК – “архивная ДНК” – хранится в низкотемпературной морозильной камере в другом здании на случай аварийных ситуаций. Третья коллекция – “рабочей ДНК” – с концентрацией около 30 нг/мкл хранится при температуре -40°C и предназначена для генотипирования разных типов маркеров в среднесрочной перспективе. Четвертый тип коллекций – “нормализованная ДНК” – с концентрацией 2 нг/мкл, подобранной для анализа SNP маркеров методом Taqman и STR маркеров коммерческими наборами, предназначена для текущих исследований.
Информация о всех семи коллекциях крови (“резервная” коллекция крови в вакутейнерах на 9 мл, “основная” коллекция крови в криопробирках на 2 мл, резервный сухой образец крови) и ДНК (“коллекционная”, “архивная”, “рабочая” и “нормализованная”) – хранится в “Базе данных образцов” (рис. 2). Основу базы данных составляют “карты морозилок” и “карты штативов”. В единой стандартизованной таблице для каждого образца указано положение на “карте штативов”, номер штатива, принадлежность к определенной популяции, концентрация коллекционной ДНК, данные по гаплогруппам Y-хромосомы и мтДНК, различная служебная информация. На “карте морозилок” для каждого штатива указано его положение (морозильник, полка, место на полке и т.д.) и код популяции.
В биобанке хранятся не только сами биологические образцы, но и сопровождающие их анкета-родословная и информированное согласие каждого обследованного (рис. 2). Кроме оригинала, информация анкеты хранится в базе данных и используется при анализе выборок. Например, при подготовке публикаций по Y-хромосоме генотипы образцов распределяются по конкретным популяциям на основании анкетной информации о местах рождения дедов обследованных, а при отборе образцов на широкогеномный и полногеномный анализ анкетная информация анализируется особенно тщательно, чтобы представить в выборке образцы из разных субпопуляций изучаемой популяции, происходящих из них строго по всем генеалогическим линиям. Для многих образцов хранится и фенотипическая информация: результаты количественного измерения цвета кожи и антропологические фотографии в трех проекциях (рис. 2), а для ряда популяций – их популяционно-демографическая характеристика.
Стратегия формирования биобанка
К репрезентативности коллекций популяционного биобанка предъявляются строгие требования. Одно из главных условий – корректное формирование выборок из популяций [33]. Это первичный и ключевой этап, и по мере появления все более мощных технологий генотипирования он становится все более критическим. Ошибка на этом этапе грозит неверными результатами на всех последующих, причем их ошибочность не смогут устранить самые совершенные методы биоинформатики. Если собранная выборка нерепрезентативно отражает генофонд популяции, то эта ошибка будет только тиражироваться по мере анализа все более совершенными методами – многомиллионными чипами, полноэкзомным и полногеномным анализом. Поэтому при создании Биобанка коренного населения Северной Евразии во всех экспедиционных обследованиях популяций использовалась единая стратегия формирования выборок. Она состояла в строгом следовании шести основным правилам.
Правило первое. “Максимум разнообразия” (охват разнообразия локальных субпопуляций)
Большинство популяций исследуются не в одной, а в нескольких субпопуляциях (этногеографических локальностях), выбранных так, чтобы они охватили максимальное разнообразие изучаемой популяции. Например, для русского населения изучаемой области обследуются два-три ее района; для народов Кавказа – два-три горных ущелья или “общества”; для народов Башкортостана, Казахстана или Калмыкии – представители ряда контрастных родов; для коренных малочисленных народов Сибири и Дальнего Востока – практически все места их компактного расселения. Для планирования, обследование каких именно субпопуляций охватит максимальное разнообразие популяции, привлекаются данные этнологии, лингвистики, антропологии, демографии, причем не только литературные данные, но и консультации с коллегами как в Москве, так и в регионе. Часто по ходу проведения экспедиции появляется новая важная информация, и экспедиционный маршрут сразу корректируется в соответствии с ней. Выборки, собранные по “правилу максимального разнообразия”, наиболее репрезентативно характеризуют популяцию в целом. Если же не следовать этому принципу и изучить популяцию только в одной случайно выбранной локальности, то ее генофонд может оказаться своеобразным в результате дрейфа генов или миграций и потому неверно отражающим общий генофонд популяции. Иными словами, для реализации этого правила учитывается структура популяции: ни одна субпопуляция, случайно вырванная из общей системы, не сможет адекватно представить общий генофонд. Только анализ различных элементов подразделенной популяции дает подробную и достоверную информацию о ее генофонде [34–37].
Не менее важен и второй аспект: выборки должны репрезентативно отражать генофонд всей изучаемой группы населения. К сожалению, при общественных обсуждениях изучения генофондов все большее распространение получает дилетантский подход, когда “наилучшими представителями” этноса считаются субпопуляции “наиболее генетически чистые”, “наиболее архаичные” или же “самые своеобразные”, а все остальные исключаются из анализа. И популяционные генетики, проводящие экспедиционное обследование, испытывают мощное давление со стороны общественности, заинтересованной в той или иной версии этногенеза и навязывающей для изучения именно тех “наилучших представителей”, которые эту версию могут подтвердить. В таких случаях особенно важно собрать выборки, позволяющие дать адекватное представление о реальной структуре и истории всего генофонда: охватить все основные географические части в пределах ареала этноса и основные субэтнические группы. Если возможности финансирования позволяют, то дополнительно исследуются и субпопуляции “по запросам общественности”, которые действительно могли сохранить наиболее древние черты генофонда. Такой подход, включающий генофонды и “современных”, и наиболее “архаичных” популяций, дает надежную реконструкцию генетической истории и позволяет избежать дилетантских искажений и в сторону древности, и в сторону “сиюминутности”. Ведь и предлагаемая некоторыми исследователями равномерная выборка (например, “квадратно-гнездовым методом”) изо всех людей, проживающих сейчас на данной территории, практически никогда не подходит для описания генофонда: она искажает его в сторону “сиюминутности”, поскольку многие люди не происходят с той территории, где обнаружены исследователем в данный момент, и их потомки с большой вероятностью тоже будут жить не здесь. Но и выборка лишь из тех людей, которые являются коренными в многовековой ретроспективе, также будет искажением, но уже в сторону древности: ведь в состав народа за прошедшие века влились потоки генов, которые стали неотъемлемой частью его генофонда.
Правило второе. “Три поколения” (учет только генетически эффективных миграций)
Это правило является продолжением предыдущего, но указывает уже, не какие локальные популяции выбирать для исследования, а каких выбирать людей из этих популяций. Согласно этому важнейшему правилу, в выборку включаются только те люди, у которых и оба его родителя, и все его бабушки и дедушки (т.е. до третьего поколения) родились в данной популяции и относили себя к данной этнической (или субэтнической) группе.
Это правило тоже призвано исключить искажения в обе стороны (“сиюминутности” и древности). Ведь согласно этому правилу, выборка не будет отражать недавние миграции в популяцию – даже мигранты во втором поколении исключаются из исследований. Это позволяет избежать искажений в сторону “сиюминутного” генетического портрета популяции, который может измениться за считанные годы при изменении ветров миграций. В то же время это правило позволяет избежать и искажений в сторону древности: ведь оно включает в число представителей популяции тех, чьи предки мигрировали в нее более трех поколений назад. И это правильно – ведь если какая-то миграция имеет потомков в этой популяции на протяжении уже трех или более поколений, то тем самым миграция доказала свою генетическую эффективность: она принесла гены в генофонд этой популяции, и эти гены не вымылись последующими обратными миграциями или дрейфом генов, а остались в популяции. Таким образом, если в родословной индивида есть предки, мигрировавшие в данную популяцию более трех поколений назад, то такие индивиды включаются в обследование.
Благодаря этому правилу снимается и вопрос об этнической принадлежности образца самого анкетируемого – она определяется по единой этнической принадлежности его предков: все предки относили себя к данному этносу.
Исключения из этого правила делаются лишь в одном случае: когда популяция уже находится на грани исчезновения и почти все ее представители метисированы. В этом случае в выборку включаются мужчины, у которых предки только по отцовской линии (отец и отец отца) родились в данной популяции и относили себя к данной этнической (или субэтнической) группе. Но такая выборка изучается только по маркерам Y-хромосомы.
Чтобы повысить долю людей, соответствующих правилу “трех поколений”, среди контингента, приходящего на генетическое обследование, сбор образцов обычно проводится не в городах, а в селах, причем в районах, удаленных от крупных транспортных трасс. Анкетирование проводит специально обученный сотрудник экспедиции, на информированном согласии ставятся подписи его и двух свидетелей из данной популяции, подтверждающих корректность процедуры анкетирования и получения информированного согласия.
Отметим еще одну особенность – в анализе и в публикациях для каждого образца указывается не место обследования индивида (где он проживает во время экспедиционного обследования), а место рождения его предков (даже, если этот населенный пункт уже исчез). При изучении Y-хромосомы указываются населенные пункты, в которых родились деды обследуемых по отцовской линии, а при изучении митохондриальной ДНК – населенные пункты, в которых родились их бабушки по материнской линии.
Правило третье. “Не родственники” (некоррелированность генотипов)
Это правило состоит в исключении из выборки родственников до третьего колена. Наличие родственных индивидов не только уменьшает генетически эффективный размер выборки, но и смещает частоты, создавая, например, иллюзию массовой миграции, если в выборку попала группа потомков давнего, но единичного мигранта. Для исключения родственников, во-первых, ориентируются на помощь “информаторов”, хорошо знающих родословные своих односельчан. Во-вторых, обследуемому предъявляется список уже прошедших обследование и предлагается найти в нем своих родственников. В-третьих, для каждого обследуемого создается анкета-родословная с указанием мест рождения обоих дедов и бабушек, их этнической, субэтнической и родовой (если известна) принадлежности. Такая анкета, нацеленная главным образом на реализацию “правила трех поколений”, также помогает выявлять и родственные связи. Наличие в анкете-родословной сведений о принадлежности к роду (клану) не только выявляет родственные связи, но и открывает новое направление в геногеографии, позволяя точнее изучать структуру популяционной системы и отслеживать потоки миграций [38–45].
Правило четвертое. “Информированность, конфиденциальность, этика”
Все обследованные обязательно дают письменное информированное согласие на предоставление биологического образца (крови, слюны, буккального эпителия) для популяционно-генетических исследований, на хранение ДНК и индивидуальной информации. Тексты информированного согласия Биобанка народонаселения Северной Евразии одобрены Этической комиссией Медико-генетического научного центра, под контролем которой проводились все экспедиции. Текст информированного согласия составляется на языке, наиболее распространенном в данной популяции, его читает каждый обследуемый (для этого возится целый набор очков разной силы), а затем обсуждается с сотрудником экспедиции, более развернуто объясняющим его содержание и отвечающим на возникшие вопросы.
Подчеркнем, что имя и адрес обследуемого появляется только на информированном согласии, которое потом хранится в сейфе для конфиденциальной информации. В анкете-родословной указываются только места рождения и этническая принадлежность предков, но не указываются имена и адреса. Поэтому анкета-родословная, в отличие от информированного согласия, не содержит конфиденциальную информацию (фактически анонимна) и потому доступна всем исследователям. Если имена, отчества и адреса обследуемых всегда строго конфиденциальны, то только фамилия в отрыве от остальных данных иногда не рассматривается как конфиденциальная информация: например, в проекте “Однофамильцы или родственники?” в свободном доступе публикуется информация о фамилии и генотипе каждого об- следуемого, но анонимность при этом не нарушается, поскольку неизвестно, о каком именно человеке с такой фамилией идет речь.
Отметим еще два правила. Согласно международным стандартам, анкетируемым никогда и ни в каком виде не оплачивается их участие в обследовании. Помимо соблюдения этических моментов, это обеспечивает надежность выборки, поскольку лица, заинтересованные в получении оплаты, склонны давать информацию, желаемую для исследователя. Второе правило формулируется как “уважение к популяции”. Оно требует знания и соблюдения как норм приличий, принятых в данной популяции (общения, одежды, конфессиональных особенностей и т.д.), так и правил этики при анкетировании, взятии образца, отбора индивидов для обследования и т.д.
Правило пятое. “Только мужчины” (максимум генетической информации)
В большинстве выборок Биобанка мужчины составляют более 95% (обычно 100%). Соблюдение этого принципа требует намного больших затрат финансов, времени и усилий экспедиционной команды, однако обеспечивает возможность анализа и Y-хромосомы, и мтДНК, и аутосомных маркеров, и Х-хромосомы, которая у мужчин находится в гемизиготном состоянии, позволяя однозначно выявлять гаплотипы. Иными словами, выборки мужчин обеспечивают возможность наиболее полного анализа генома. Оптимальный объем выборки из популяции, обеспечивающий надежный анализ “однородительских” маркеров, – около 100 человек, и большинство популяций в биобанке представлены выборками с объемом не менее 70–100 человек.
Правило шестое. “Образцы крови” (максимальное количество ДНК)
Для долговременного хранения и обеспечения большого количества ДНК и, следовательно, извлечения в будущем максимума генетической информации о каждом обследуемом в качестве биологического материала практически всегда берутся образцы венозной крови (от 4 до 13 мл). Забор крови осуществляется с помощью “вакутейнеров” (Vacuette) – разовых вакуумных пробирок для забора венозной крови с ЭДТА, напыленным на стенки пробирки. Только в редких случаях собираются образцы слюны и в редчайших – образцы буккального эпителия. Обычно это труднодоступные популяции, когда невозможно привлечь медперсонал для забора крови, или, например, было решено не собирать кровь при формировании выборки в Афганистане из-за неспокойной обстановки.
Региональные биобанки
Биобанк “Северная Евразия” создавался большим коллективом – лаборатории популяционной генетики человека Медико-генетического научного центра, лаборатории геномной географии Института общей генетики, научного центра “Северная Евразия” международного проекта Genographic, в сотрудничестве с региональными российскими и зарубежными учеными. В рамках этой работы созданы и региональные биобанки. Большинство из них являются составной частью Биобанка Северной Евразии, но часть распределена в виде “реплик”, локализованных на базе региональных организаций.
Биобанк народов Восточной Европы
Восточно-европейский региональный биобанк включает? 6300 образцов из 70 популяций: белорусов, болгар, вепсов, гагаузов, казаков (донских, запорожских, кубанских, некрасовских, терских), карел, литовцев, молдаван, русских, украинцев, цыган. Наиболее многочисленны популяции русских (30 популяций) и украинцев (13 популяций). Для ряда коллекций образцы ДНК сопровождаются количественным измерением цвета кожи и антропологическими фотографиями донора. В монографии “Генофонд Европы” [46] и в работе [47] представлены результаты исследований генофонда славян и балтов: успешность исследований обеспечена высокой информативностью регионального биобанка, достигнутой благодаря четкой стратегии формирования выборок и покрытия ими различных региональных групп по всему историческому ареалу восточных славян [48–50].
Биобанк народов Крыма
Крымский региональный биобанк включает более 500 образцов из шести популяций: крымских татар (степного, горного и южнобережного субэтносов), крымских греков (ромеев и урумов), караимов. Биобанк формировался задолго до недавних политических событий совместными дружными усилиями российских и украинских генетиков и при активной поддержке национальных общин. При формировании выборок, несмотря на нынешнее дисперсное расселение изученных народов, четко соблюдено правило трех поколений – все предки относили себя не только к определенному этносу, но и к субэтносу. На основе биобанка уже проведено изучение как однородительских маркеров (включая полное секвенирование Y-хромосомы и мтДНК), так и “широкогеномной” панели аутосомных маркеров [51]. Показано, что генофонд крымских татар и греков сформировался в ходе взаимодействия населения Восточного Средиземноморья и степей Евразии, а генофонд караимов сохранил переднеазиатское наследие.
Биобанк народов Кавказа
Кавказский региональный биобанк содержит 6100 образцов из 55 популяций и охватывает большинство не только этносов, но и субэтносов Кавказа: абазин, абхазов, аварцев, адыгейцев, азербайджанцев, армян, балкарцев, грузин, даргинцев, езидов, ингушей, кабардинцев, кайтагцев, караногайцев, карачаевцев, кубачинцев, кумыков, курдов, лакцев, лезгин, ногайцев кубанских, осетин, табасаранцев, черкесов, чеченцев. Для ряда коллекций образцы ДНК сопровождаются количественным измерением цвета кожи и антропологическими фотографиями донора. Формирование биобанка проводилось в три этапа. На первом были изучены народы северокавказской языковой семьи и ираноязычные осетины. На втором – все тюркоязычные этносы как представители более поздних миграций на Кавказ. На третьем этапе изучены народы Закавказья. На первом этапе полное согласие результатов, полученных четырьмя независимыми методами, позволило сформулировать надежный вывод: генетическая и лингвистическая структуры “автохтонного” народонаселения Кавказа жестко связаны друг с другом самой его историей [52]. При анализе генофонда тюркоязычного населения Кавказа выявлена высокая гетерогенность его Y-хромосомного генофонда [53–55]. Изучение генофонда Закавказья выявило его связи с популяциями Северного Кавказа и Передней Азии [56].
Приведем и два примера проверки надежности Биобанка Северной Евразии. При повторном обследовании кубанских ногайцев и увеличении выборки до субтотальной их “генетический портрет” не изменился. Аналогично, детальное сравнение итогов изучения генофондов карачаевцев и балкарцев выявило сходство “генетических портретов”, полученных по данным Биобанка народонаселения Северной Евразии и уфимского биобанка [57]. Оба примера подтвердили, что выявленная гетерогенность тюрков Кавказа является объективной, а стратегия формирования биобанка – надежной.
Биобанк коренного населения Урала и предкавказских степей
Уральский региональный биобанк включает 3600 образцов из 49 популяций башкир, бесермян, калмыков, мишарей, мордвы-мокша, мордвы-эрзя, мордвы-шокша, ногайцев астраханских и ставропольских, удмуртов, татар астраханских, казанских и кряшен, чувашей. Для ряда коллекций образцы ДНК сопровождаются количественным измерением цвета кожи и антропологическими фотографиями донора. Благодаря биобанку были впервые генетически изучены астраханские татары и астраханские ногайцы, генофонды которых оказались отличны не только друг от друга, но и от родственных им казанских татар. Народы, сохранившие родовую структуру (башкиры, калмыки, ногайцы, удмурты), исследованы с ее учетом, а когда родоплеменная принадлежность была частично утрачена, она реконструировалась историческими и этнографическими методами в тесном сотрудничестве с этнологами и историками [58–61]. Это обеспечило новый уровень изучения генофонда Уральского региона [33] и показало необходимость дальнейшего пополнения Биобанка Северной Евразии коллекциями из всех остальных этносов и субэтносов региона, собранных по этой же стратегии.
Биобанк коренного населения Сибири и Дальнего Востока
Этот региональный биобанк охватывает самый обширный ареал и включает 3600 образцов из 43 популяций коренных народов: алтай-кижи, буряты, качинцы, койбалы, кумандинцы, кызыльцы, нанайцы, негидальцы, ненцы, сагайцы, сибирские татары (семь субэтносов тоболо-иртышских и барабинских), теленгиты, тофалары, тубалары, тувинцы, тувинцы-тоджинцы, ульчи, хамнигане, челканцы, шорцы (верхнеабаканские и горно-таежные), эвенки, якуты. Для ряда коллекций образцы ДНК сопровождаются количественным измерением цвета кожи и антропологическими фотографиями донора. Специфика Сибирского регионального биобанка определяется малочисленностью и дисперсностью расселения коренного населения, высоким уровнем инбридинга, несовершенством этнических дефиниций и интенсивным смешением с пришлым населением. Зачастую требуется тотальный охват мест компактного расселения, помощь информаторов для уточнения генеалогий, тесный контакт с этнологами, антропологами, историками, лингвистами, работа в архивах и т.д. [62]. Исследования на основе биобанка внесли вклад в решение проблемы заселения Американского континента [63] и выявили несоответствие структуры генофонда многим общепринятым классификационным схемам сибирских народов. Так, крайне высокая генетическая гетерогенность хакасов, алтайцев, сибирских татар может указывать на искусственность объединения малых народов Хакасии, Алтая и тюрков Западной Сибири по территориальному признаку [64–67].
Биобанк коренного населения Центральной Азии
Центральноазиатский региональный биобанк включает около 5400 образцов из 51 популяции, собранных главным образом в рамках международного проекта Genographic в населении шести стран – Афганистана, Казахстана, Киргизии, Монголии, Таджикистана и Узбекистана: бартангцы, ванчцы, ваханцы, дунгане, ишкашимцы, казахи, каракалпаки, киргизы, монголы (различные группы), пуштуны, рушанцы, таджики (горные и равнинные), туркмены, узбеки, уйгуры, хуфцы, шахдаринцы, шугнанцы, ягнобцы, язгулямцы. Для ряда коллекций образцы ДНК сопровождаются количественным измерением цвета кожи и антропологическими фотографиями донора. Важная особенность этого биобанка – тщательное отслеживание сведений о родовой и генеалогической структуре, что позволило, например, оценить скорость мутаций Y-хромосомы по данным полногеномного секвенирования [43], выявить роль родовой структуры в формировании архитектоники генофонда и ее связь с географическим и культурным ландшафтом региона [68], верифицировать гипотезы этногенеза ряда групп населения [40, 69]. Биобанк активно применяется для решения задач судебно-медицинской экспертизы: 1400 образцов венозной крови, собранные в рамках проекта Genographic в 14 районах, равномерно покрывающих Казахстан, переданы по решению руководства проекта в Центр судебной экспертизы Министерства юстиции Республики Казахстан. Параллельно National Laboratory Astana Назарбаев Университета в сотрудничестве с нашим коллективом ведет активное формирование регионального биобанка Казахстана как основы для развития персонализированной медицины. Он уже включает 1200 образцов 11 родов из 15 районов ареала Старшего жуза [70], 400 образцов различных родов Среднего и Младшего жузов, более 300 образцов уйгуров и узбеков Казахстана. Кроме указанных 5400 образцов, нацеленных на изучение структуры генофонда, региональный биобанк включает также 2000 образцов для анализа биомаркеров старения [71, 72] и 1400 образцов для анализа эколого-социальных и генетических факторов восприимчивости к туберкулезу [73].
Использование популяционных биобанков в медицинской генетике
Спектр направлений использования популяционных биобанков обширен. Поэтому, кроме фун- даментальных исследований генофондов, кратко опишем еще две интенсивно развивающиеся сферы: медицинская генетика и криминалистика.
Все большее значение приобретает персонализированная медицина, нацеленная на лечение пациента с учетом индивидуальных особенностей его генома. Но если пациенты происходят из определенной популяции, то их индивидуальные геномы отражают и особенности популяционного генофонда. Популяции различаются по частотам аллелей, в том числе ассоциированных с заболеваниями. Поэтому важным шагом перехода к персонализированной медицине индивида служит “персонализированная медицина популяций”.
Проект “1000 геномов” выявил необходимость региональных биобанков. Каталог ассоциаций с заболеваниями показывает, что 35% геномных вариаций не являются общими для населения даже в пределах одного континента [74]. Поэтому отсутствие региональных биобанков коренного населения или пренебрежение особенностями структуры генофонда при формировании выборок в клинических моделях исследований (ретроспективное исследование случай-контроль, непараллельный контроль, когортные исследования) накладывают серьезные ограничения на геномный (GWAS) и эпигеномный (EWAS) поиск ассоциаций с заболеваниями, прогноз заболеваемости и планирование их лечения.
Рассмотрим использование биобанка для задач медицинской генетики…
Анализ географического распространения ключевых аллелей, ассоциированных с заболеваниями
Эту область применения биобанков проиллюстрируем исследованием распространенности онкогена MDM2, проведенным нами вместе с норвежскими коллегами [75]. Белок MDM2 регулирует активность белка р53. Один аллель MDM2 – SNP309G – резко увеличивает вероятность развития ряда видов рака, но субвариант этого аллеля, несущий дополнительную мутацию SNP285C в промоторе, напротив, уменьшает активность гена и снижает риск развития рака.
Исследование распространения SNP285C охватило более 10 тыс. человек из 25 популяций Старого Света. Столь большая выборка достигнута благодаря Биобанку Северной Евразии, а также ряда популяционных биобанков Передней Азии и Западной Европы. Показано (рис. 3), что наибольшая частота аллеля SNP285C (6-8%) характерна для европейских популяций, за исключением финнов и саамов (у них частота около 1%). На юг и на восток от Европы частота аллеля постепенно убывает (в Передней Азии составляя 4-5%, в Южной Сибири – около 4%) и опускается до нуля в Африке, Центральной и Восточной Азии. Таким образом, этот аллель свойствен популяциям Западной Евразии (европеоидам по антропологической классификации), что подтверждается и полученными датировками его возникновения (после отделения западно-евразийского популяционного ствола [75]). В работе сделан вывод, что популяционные частоты SNP285C важны при оценке риска развития определенных видов рака.
Биобанк коренного населения Северной Евразии используется и для других подобных проектов – анализа распространения аллелей генов, привлекающих особое внимание медицинских генетиков. Так, изучается полиморфизм генов биотрансформации ксенобиотиков I и II, генов репарации ДНК для исследований генетической адаптации популяций; для анализа подверженности коренного населения мультифакториальным заболеваниям – распространение аллелей генов интерлейкинов и генов, ассоциированных с заболеваниями сердечно-сосудистой системы; проводится популяционный скрининг социально значимых генов биотрансформации этанола (ADH1B, ALDH2, CYP2E1) и т.д.
Формирование контрольных выборок
Другая область применения популяционных биобанков – подбор адекватных контрольных выборок к уже имеющимся выборкам больных. Например, Биобанк Северной Евразии позволил корректно подобрать популяционный контроль к выборке страдающих мужским бесплодием носителей делеции b2/b3 AZF С-региона Y-хромосомы: представителей тех же русских популяций, что и пациенты [49]. Благодаря правильно подобранному контролю удалось выявить высокодостоверную связь делеции b2/b3 с Y-хромосомной гаплогруппой N1-LLY22g [10]. Отметим, что, хотя делеция и возникает преимущественно у носителей именно гаплогруппы N1-LLY22g, это не мешает остальным носителям гаплогруппы успешно увеличиваться в численности: по обширности ареала распространения N1-LLY22g занимает второе место в России и, например, многочисленный род Рюриковичей представлен в основном носителями именно этой гаплогруппы.
Прогноз груза наследственной патологии и мониторинг генофонда
Еще один раздел геномной медицины, опирающийся на популяционные биобанки и геногеографические исследования, – прогнозирование груза наследственной патологии. Из теории популяционной генетики известно, что интенсивный дрейф генов коррелирован со случайным инбридингом, поскольку оба – отражения ограниченного генетически эффективного размера популяции, а уровень инбридинга, в свою очередь, определяет уровень груза наследственной патологии. Исследования коллектива под руководством акад. РАН Е.К. Гинтера убедительно показали, что генофонд не только в теории, но и на практике прочно коррелирован с генетическим грузом [76, 77].
Поэтому с целью прогноза величины груза на основе анализа образцов из Биобанка Северной Евразии была создана карта внутрипопуляционного разнообразия [78]. Полученный прогноз груза был сопоставлен с прямыми оценками при медико-генетическом обследовании (для тех популяций, где такие прямые оценки имелись) и выявлена достоверная корреляция [78].
Знание структуры генофонда необходимо и для эколого-генетического мониторинга [79], поскольку в том же исследовании [78] выявлена взаимосвязь многих экологических и генетических параметров: продуктивности среды, плотности населения, эффективного размера популяции, изоляции субпопуляций, дрейфа генов, гаплотипического разнообразия, генетического груза.
Фармакогеномика и районирование генофонда
![Карта распределения относительной частоты мутации в позиции 285 на фоне мутации 309 гена MDM2 в Евразии. Черные точки обозначают генотипированные популяции (по [75], с изменениями).](http://xn--80aba1amre.xn--p1ai/wp-content/uploads/2020/05/Mutacii-300x232.png)
Рис.3 Карта распределения относительной частоты мутации в позиции 285 на фоне мутации 309 гена MDM2 в Евразии. Черные точки обозначают генотипированные популяции (по [75], с изменениями).
Значение использования популяционных биобанков в фармакологии показывает история препарата Gefitinib. В 2004 г. этот препарат провалился в международном клиническом испытании ISEL. К счастью, компания-разработчик создала хороший биобанк, в котором систематически хранила образцы опухолей от участников исследования с четким указанием их популяционной принадлежности. Это позволило компании выявить связь между ответом на препарат Gefitinib и мутациями в гене EGFR, которые чаще встречаются в коренном населении Азии, для которого препарат эффективен. К 2009 г. препарат был одобрен для пациентов с мутациями EGFR [80].
Более сложный и важный пример использования биобанков и геногеографии для фармакогеномики – выявление генетических барьеров. Хотя в человечестве нет ни одного “забора”, непроходимого для генов, но в нем нет и гомогенности, и географически плавная клинальная изменчивость зачастую нарушается внезапными перепадами частот, указывающими на барьеры для потока генов, на их “бег с препятствиями”. Барьеры эти могут быть связаны и с географией, и с культурными особенностями (касты в Индии, родовая структура у народов Евразийской степи, конфессиональные особенности брачной структуры), и с дальними миграциями. Выявление барьеров позволяет сегментировать генофонд крупного региона на субгенофонды, которые внутри себя относительно гомогенны, а между собой – резко различаются. Легко представить, сколь важно такое районирование для фармакогеномики: население разных сегментов различается по большинству генов, включая гены метаболизма лекарств, а население в пределах сегмента будет сходным [32, 33]. Поэтому, имея карту районирования генофонда, достаточно изучить гены метаболизма лекарств в одной-двух популяциях каждого сегмента, чтобы обоснованно прогнозировать частоты этих аллелей практически в любой популяции. И, при отсутствии для индивида дорогостоящего секвенирования его собственного генома, можно опираться на данные о том сегменте, из народонаселения которого он происходит.
Анализ генетических барьеров в генофонде Северной Евразии проведен по данным об аутосомных маркерах, Y-хромосомы и мтДНК: выявлена сегментация на субрегионы, локализация и значимость барьеров между ними. Результирующие карты созданы в программе GeneGeo [33] с помощью метода “плывущего окна” [81]: межпопуляционное разнообразие оценивалось в пределах “окна”, окружающего поочередно каждую точку территории: высокое разнообразие возникает на стыках контрастных генофондов, выявляя барьеры.
Для построения таких карт репрезентативность популяционного биобанка приобретает особое значение. Ведь если часть территории не покрыта изученными популяциями, то генетические барьеры там не будут обнаружены. А недостаточная репрезентативность выборок, напротив, может дать сигналы наличия барьеров там, где на самом деле их нет.
Использование популяционных биобанков для криминалистики
Формирование референсных баз данных для ДНК-идентификации
ДНК-идентификация личности основана на совпадении ДНК-профиля образца, который необходимо идентифицировать, с образцом уже известного лица. Но надо еще доказать, что вероятность совпадения с каким-либо иным лицом пренебрежимо мала. А чтобы рассчитать вероятность такого случайного совпадения с “человеком с улицы”, необходимо знать частоты аллелей на этой “улице”, т.е. в популяции. А поскольку частоты аллелей в разных популяциях различны, криминалистике необходимы референсные базы данных по всем популяциям мира.
Такие референсные базы данных для народонаселения России долгое время отсутствовали, но в 2011 г. на основе томского и уфимского биобанков был проведен анализ образцов из шести городов и 11 этнических групп России [29], а на основе Биобанка коренного населения Северной Евразии была создана база данных для сельского русского населения [30]. Обе референсные базы данных размещены в свободном доступе (на веб-сайтах medgenetics.ru, vigg.ru и сайте нашего коллектива genofond.ru). Широко используется и референсная база данных о частотах аутосомных STR-маркеров в 15 городах России и разработанные специалистами МВД методические рекомендации [82].
Определение вероятного этногеографического происхождения
![Зоны преимущественного накопления различных гаплогрупп Y-хромосомы в населении Европы (по [43], [46])](http://xn--80aba1amre.xn--p1ai/wp-content/uploads/2020/05/Gaplogruppy-300x300.jpeg)
Рис.4 Зоны преимущественного накопления различных гаплогрупп Y-хромосомы в населении Европы (по [43], [46])
В криминалистике нередко возникает задача определить вероятное этногеографическое происхождение индивида, когда все, что о нем известно – это биологический образец, обнаруженный на месте преступления. Маркеры с высокими межпопуляционными различиями (в особенности Y-хромосома) делают решение этой задачи вполне реальным, но при условии, что популяция, из которой происходит этот индивид, представлена в биобанке.
Геногеографические Атласы Y-хромосомы и мтДНК [33] помогают определить вероятный регион происхождения по отцовской (рис. 4) и материнской линиям. Дополнением служит анализ STR-гаплотипа с помощью отечественной программы Haplomatch [83]: программа указывает, в каких популяциях обнаружены идентичные и близкие гаплотипы. Эта информация извлекается из базы данных, большинство гаплотипов которой относится к образцам Биобанка Северной Евразии.
Такой алгоритм определения вероятного происхождения по мужской линии уже регулярно используется в практике российской криминалистики. Например, когда Следственный комитет сообщил нашему коллективу STR-гаплотип образца с места теракта в аэропорту Домодедово, нами в течение двух дней было выявлено, что он относится к варианту, встреченному только в населении Ингушетии, что помогло оперативно установить личность исполнителя теракта (рис. 4). Но такая высокая точность и надежность определения происхождения достигается далеко не всегда. Для ее повышения необходим, во-первых, полногеномный анализ Y-хромосомы, выявляющий новые высокоинформативные SNP-маркеры, и, во-вторых, пополнение биобанка новыми популяционными выборками для массового скрининга этих маркеров и более плотного покрытия территории России и сопредельных стран изученными популяциями (рис. 1).
Заключение
Приведенные примеры самых разнообразных исследований, которые были выполнены с помощью Биобанка народонаселения Северной Евразии и других популяционных биобанков, убедительно свидетельствуют о значимости этого направления для фундаментальной и прикладной науки. Наиболее острыми проблемами развития популяционных биобанков России является необходимость их интенсивного пополнения репрезентативными выборками с четко документированной информацией и создание продуманных биоинформационных систем для каталогизации, хранения и мониторинга использования и состояния биообразцов. Потенциал использования биобанков как ресурсов информации о генофондах будет постоянно расти, способствуя развитию в нашей стране фундаментальных исследований, персонализированной медицины, эколого-генетического мониторинга и возможностей судебно-медицинской экспертизы.
Благодарности
Биобанк создается с 1998 г. по настоящее время, и работы в разные годы финансировались международным проектом The Genographic project, РФФИ, РГНФ, РНФ, Эстонским биоцентром и за счет собственных средств держателей образцов. В настоящее время работа выполняется при поддержке гранта РНФ 14-14-00827, грантов РФФИ (16-04-00890_а, 16-06-00303_а, 16-36-00122_мол_а; 16-34-00506_мол_а, 16-06-00364_а, 14-06-00384_а, 14-06-00272_а). В том числе средства гранта РНФ 14-14-00827 были использованы для подготовки данного обзора. Работа была также поддержана Программно-целевым финансированием МОН РК (№ 0114РК00492) Назарбаев Университет.
Выражаем благодарность в организации экспедиций и в сборе биологических материалов:
для Биобанка народов Восточной Европы: проф. Л.А. Атраментовой (Харьковский национальный университет им. В.Н. Каразина), проф. М.И. Чурносову, д.м.н. И.В. Евсеевой, Д.М. Дарагану, к.и.н. П.П. Реутову, Е.С. Павловой, к.б.н. Э.В. Гарину (Институт биологии внутренних вод им. И.Д. Папанина), А.Г. Шлыкову, Э.В. Темяткину (Этнографический музей кацкарей), К.Г. Черневскому, С.И. Фокину, проф. Л.А. Тегако и к.м.н. О.В. Тегако, д.м.н. М.Н. Болдыревой, проф. В. Кучинскасу, д.б.н. Н.А. Дубовой;
для Биобанка коренного населения Сибири и Дальнего Востока: к. б. н. М.В. Ульяновой (Кемеровский государственный университет), к. и. н. З.А. Тычинских (Тобольский педагогический институт), А.Г. Балаганскому, к. ф. н. А.Г. Букину и к. ф. н. Д.Б. Сундуевой (Забайкальский государственный университет), к. б. н. А.А. Богуновой и к. и. н. Е.Н. Каменщиковой (Амурский гуманитарно-педагогический государственный университет);
для Биобанка народов Крыма: главному врачу Медицинского центра по обслуживанию депортированных народов Л.А. Мустафьевой, к. г. н. Н.В. Качанову, Караимскому обществу Москвы, к. т. н. Н.М. Макмаку, А.А. Малтабару, И.Н. Тасиц;
для Биобанка народов Кавказа: проф. Л.М. Епископосяну (Институт молекулярной биологии НАН, Армения); Г.И. Андриадзе и Н.Н. Чиковани (Грузинский университет им. Андрея Первозванного, Грузия), О.Ш. Кудухову, К.Т. Момыналиеву (РГП “Национальный центр биотехнологии” Комитета науки министерства образования и науки Республики Казахстан), к. б. н. П.К. Квициния (Абхазский институт гуманитарных исследований им. Д.И. Гулиа АНА, Абхазия);
для Биобанка коренного населения Уральского региона и предкавказских степей: к. и. н. Н.В. Пислегину и к. и. н. В.С. Чуракову (Удмуртский институт истории, языка и литературы УрО РАН), к. и. н. Р.М. Рыскулову и Р.Р. Шайхееву (Центр антропологии и социальной культурологии Института социально-политических и правовых исследований Республики Башкортостан), З.С. Елбанбетову (администрация Нефтекумского района Ставропольского края), к. п. н. Э.Ш. Идрисову (Астраханский филиал Российской академии народного хозяйства при Президенте РФ), Р.И. Мансурову;
для Центрально-Азиатского биобанка – PhD Ж.М. Сабитову (Евразийский национальный университет им. Л.Н. Гумилева); И.М. Тажигуловой (Центр судебной экспертизы Министерства юстиции Республики Казахстан); коллективу National Laboratory Astana Назарбаев Университет – генеральному директору д. м. н. Ж.Ш. Жумадилову, н. с. А. Аскапулы, д. м. н. А.Р. Акильжановой, к. м. н. А.Т. Супиеву, д. м. н. Р.Б. Исаевой; д. б. н. Ш.У. Турдикуловой (Центр высоких технологий Академии наук Республики Узбекистан), к. б. н. Д.А. Далимовой и Д.Х. Давлетчурину (Институт биоорганической химии Академии наук Республики Узбекистан), акад. П. Нимадава (Монгольская Академия медицинских наук, Монголия), д. б. н. Ж.И. Исаковой (НИИ молекулярной биологии и медицины министерства здравоохранения Кыргызской Республики).
Список литературы
- Vaught J.B., Henderson M.K., Compton C.C. Biospecimens and biorepositories: from afterthought to science // Cancer Epidemiol. Biomarkers Prev. 2012. V. 21. № 2. P. 253- doi 10.1158/1055-9965.EPI-11-1179
- Абрамсон Н.И., Ананьева Н.Б., Подлипаев С.А., Пугачев О.Н. Коллекции ДНК – новый путь изучения и сохранения биологического разнообразия // Фундаментальные зоологические исследования. Теория и методы: По материалам Междунар. конф. “Юбилейные чтения, посвященные 170-летию Зоологического института РАН”. М.; СПб.: КМК, 2004. С. 273-282.
- Simeon-Dubach D., Watson P. Biobanking 3.0: Evidence based and customer focused biobanking // Clinical Biochem. 2014. V. 47. № 4- P. 300-308. doi 10.1016/j.clinbiochem.2013.12.018
- Baker M. Biorepositories: Building better biobanks // Nature. 2012. V. 486. P. 141- doi 10.1038/486141a
- Vaught J.B., Lockhart NC. The evolution of biobanking best practices // Clin. Chim. Acta. 2012. V. 413. № 19- P. 1569-1575. doi 10.1016/j.cca.2012.04.030
- Alice Park 10 Ideas Changing the World Right Now: Biobanks // Time Thursday, [Электронный ресурс]. Сайт Content.time, 2009. Дата размещения 12/03/2009. content.time.com/time/specials/packages/article/ 0,28804,1884779_1884782_1884766,00.html
- Biobanking for Medical R&D: Technology and Market 2010-2025. Pharma report [Электронный ресурс]. Сайт Visiongain. 2010. Дата публикации 19/08/2010. URL: visiongain.com/report_license.aspx?rid=513
- Юнес Р.А., Полуэктова Е.У., Даниленко В.Н. Криобанк микробиоты российского человека // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2. С. 20.
- Глотов А.С., Баранов В.С. Перспективы биобанкирования в генетике репродукции // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2. С. 20.
- Дибирова Х.Д., Черных В.Б., Кузнецова М.А. и др. Связь контекста Y-хромосомы с бесплодием у мужчин: Конф. программы РАН “Молекулярная и клеточная биология: прикладные аспекты”. 13 апреля 2012. М., 2012. С. 10.
- Кузнецова М.А., Чухряева М.И., Агджоян А.Т. и др. Биобанк Северной Евразии: массовый скрининг популяций и геногеография субвариантов гаплогруппы N1c, выявленных при полногеномном секвенировании // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 26.
- Чухряева М.И., Лукьянова Е., Quintano-Murci L., Балановский О.П. Генофонд популяций индоевропейской лингвистической семьи: полногеномный анализ на основе использования биобанков // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 40.
- Brotherton P., Haak W., Templeton J. et al. Neolithic mitochondrial haplogroup H genomes and the genetic origins of Europeans // Nature Commun. 2013. V. 4. P. 1764. doi 10.1038/ncomms2656
- Behar D.M., Metspalu M., Baran Y. et al. No Evidence from Genome-Wide Data of a Khazar Origin for the Ashkenazi Jews // Human Biol. 2013. V. 85. № 6. P. 859–900. URL: dx.doi.org doi 10.1371/jour- nal.pgen.1005068
- Raghavan M., Skoglund P., Graf K. et al. Upper Palaeolithic Siberian genome reveals dual ancestry of Native Americans // Nature. 2014. V. 505(7481). № 2. P. 87- doi 10.1038/nature12736
- Sarkissian C.D., Brotherton P., Balanovsky O. et al. Mitochondrial genome sequencing in mesolithic north east europe unearths a new sub-clade within the broadly distributed human haplogroup C1 // PLoS One. 2014. V. 9(2). e87612. doi 10.1371/journal.pone.0087612
- Brandt G., Haak W., Adler C.J. et al. Ancient DNA reveals key stages in the formation of central european mitochondrial genetic diversity // 2013. V. 342(6155). P. 257-261. doi 10.1126/science.1241844
- Melé M., Javed A., Pybus M. et al. Recombination gives a new insight in the effective population size and the history of the old world human populations // Mol. Bi- ol. Evol. 2012. V. 29(1). P. 25-
- Haak W., Balanovsky O., Sanchez J.J. et al. Ancient DNA from European early neolithic farmers reveals their near eastern affinities // PLoS Biol. 2010. V. 9. V. 8(11). e1000536. doi 10.1371/journal.pbio.1000536
- Sarkissian C., Balanovsky O., Brandt G. et al. Ancient DNA Reveals prehistoric gene-flow from siberia in the complex human population history of North East Europe // PLoS Genet. 2013. V. 9(2). e1003296. doi 10.1371/journal.pgen.1003296
- Elhaik E., Tatarinova T., Chebotarev D. et al. Geographic population structure analysis of worldwide human populations infers their biogeographical origins // Nature Commun. 2014. № 5. P. 3513. doi 10.1038/ncomms4513
- Karmin M., Saag L., Vicente M. et al. A recent bottleneck of Y chromosome diversity coincides with a global change in culture // Genome Res. 2015. V. 25(4). P. 459- doi 10.1101/gr.186684.114
- Underhill P.A., Poznik G.D., Rootsi S. et al. The phylogenetic and geographic structure of Y-chromosome haplogroup R1a // Eur. J. Hum. Genet. 2015. V. 23(1). P. 124- doi 10.1038/ejhg.2014.50
- Lazaridis I., Patterson N., Mittnik A. Ancient human genomes suggest three ancestral populations for presentday Europeans // Nature. 2014. V. 513(7518). P. 409- doi 10.1038/nature13673
- Балановский О.П. Генофонд человека: глобальные тренды изменчивости в пространстве и во времени // VI Науч. школа молодых ученых по экологич. генетике “Экологическая генетика популяций”. 16-19 октября 2012. Санкт-Петербург, С. 7-8.
- Балановская Е.В., Балановский О.П. Популяционная генетика человека // Наследственные болезни: национальное руководство / Под ред. академиков РАМН Бочкова Н.П., Гинтера Е.К. и Пузырева В.П. М.: ГЭОТАР-Медиа, 2012. С. 199-243.
- Гуреев А.С., Ким А.А., Санина Е.Д. и др. Распределение частот vntr аллелей локуса 5-httlpr гена транспортера серотонина в населении Евразии и Африки // Экологич. генетика человека. 2014. Т. 12. № 3. С. 71-86.
- Жабагин М.К., Аскапулы А., Сабитов Ж. и др. Геногеографические биобанки на службе у персонализированной медицины // Мат. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт- Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 57.
- Степанов В.А., Балановский О.П., Мельников А.В. и др. Характеристика популяций Российской Федерации по панели пятнадцати локусов, используемых для ДНК-идентификации и в судебно-медицинской экспертизе // Acta Naturae. 2011. Т. 3. № 2(9). С. 59-71.
- Песик В.Ю., Федюнин А.А., Агджоян А.Т. и др. Разнообразие региональных русских популяций по STR-маркерам, используемым при ДНК-идентификации // Генетика. 2014. Т. 50. № 6. С. 715–723.
- Утевская О.М., Атраментова Л.А. Биобанки как основа для создания референсных баз ДНК-идентификации в судебно-медицинской экспертизе // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 59.
- Балановская Е.В., Атраментова Л.А., Богунов Ю.В. и др. Биобанк населения Северной Евразии // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 17.
- Балановский О.П. Геногеография – медицине // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 17-
- Балановская Е.В., Нурбаев С.Д., Балановский О.П. и др. Геногеографический анализ подразделенной популяции. I. Генофонд адыгов в системе кавказских генофондов // Генетика. 1999. Т. 35. № 6. С. 818-830.
- Балановская Е.В., Почешхова Э.А., Балановский О.П., Гинтер Е.К. Геногеографический анализ подразделенной популяции. II. География случайного инбридинга (по частотам фамилий адыгов) // Генетика. 2000. Т. 36. № 8. С. 1126-1139.
- Балаганская О.А. Полиморфизм Y-хромосомы у тюркоязычного населения Алтая, Саян, Тянь-Шаня и Памира в контексте взаимодействия генофондов Западной и Восточной Евразии: Дис. … канд. биол. наук. М.: Медико-генетический научный центр РАМН, 2011.
- Балаганская О.А., Лавряшина М.Б., Богунова А.А. и др. Изучение популяционных систем как принцип создания биобанков (на примере народов Южной Сибири) // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 16-
- Zhabagin M., Sabitov Z., Tazhigulova I. et al. The gene pool of Argyn in the context of generic structure of Kazakhs according to data on SNP-Y-chromosome markers // Europ. Human Genet. Conf. Paris, France. 06/2013. P. 570.
- Zhabagin M., Tarlykov P.V., Sabitov Zh.M. et al. The possible role of social selection in the distribution of the “Proto-Mongolian” haplotype in Kazakhs, Kyrgyz, Mongols and other Eurasian populations // Amer. Soc. Human Genet. 63rd Annual Meeting, Boston, USA 10/2013. P. 236.
- Жабагин М.К., Дибирова Х.Д., Фролова С.А. и др. Связь изменчивости Y-хромосомы и родовой структуры: генофонд степной аристократии и духовенства казахов // Вестн. Моск. ун-та. Сер. XXIII. Антропология. 2014. № 1. С. 96-
- Zhabagin M., Sabitov Zh., Dibirova H. et al. Characteristics of Y-chromosome Polymorphisms in Kazakh Populations from the Perspective of Tribal-clan structure // Europ. Human Genet. Conference 2014, Milan, Italy. 05/2014. P. 510.
- Zhabagin M., Sabitov Zh., Balanovsky O. Genetic polymorphism of 17 Y-chromosomal STR loci in the Kozha and Tore tribes of Kazakh population. DNA in Forensics. 2014. Brussels. 05/2014. P.107.
- Balanovsky O., Zhabagin M., Agdzhoyan A. et al. Deep phylogenetic analysis of haplogroup G1 provides estimates of SNP and STR mutation rates on the human Y-chromosome and reveals migrations of Iranic speakers // PLoS One. 2015. Apr. 7. Epub ahead of print. org/ doi 10.1371/journal.pone.0122968
- Богунов Ю.В., Мальцева О.В., Богунова А.А., Балановская Е.В. Нанайский род самар: структура генофонда по данным маркеров Y-хромосомы // Археология, этнография и антропология Евразии. 2015. Т. 43. № 2. С. 146-152.
- Zhabagin M., Balanovsky O., Sabitov Z. et al. Gene geography of Kazakh populations from the Y-chromosomal data // Human Genome Meeting. 2015. Kuala Lumpur, Malaysia. 03/2015. P. 133-
- Балановский О.П. Генофонд Европы. Москва: Товарищество научных изд. КМК, 2015. 338 с.
- Kushniarevich A., Utevska O., Chuhryaeva M. et al. Genetic heritage of the Balto-Slavic speaking populations: a synthesis of autosomal, mitochondrial and Y-chromosomal data // PLoS One. 2015. Sep. 2. Epub ahead of print. doi org/10.1371/journal.pone.0135820
- Балановская Е.В., Балановский О.П. Русский генофонд на Русской равнине. М.: ООО “Луч”, 2007. 416 с.
- Balanovsky O., Rootsi S., Pshenichnov A. et al. Two sources of the Russian patrilineal heritage in their Eurasian context // Am. J. Hum. Genet. 2008. V. 82. № 1. P. 236- doi 10.1016/j.ajhg.2007.09.019
- Pshenichnov A., Balanovsky O., Utevska O. et al. Genetic affinities of Ukrainians from the maternal perspective // Amer. J. Physical. Anthropol. 2013. V. 152(4). P. 543–550. doi 10.1002/ajpa.22371
- Агджоян А.Т., Кузнецова М.А., Чухряева М.И. и др. Биобанк коренных народов Крыма как основа реконструкции этногенеза, по данным анализа трех генетических систем маркеров // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 5.
- Balanovsky O., Dibirova K., Dybo A. et al. Parallel evolution of genes and languages in the caucasus region // Mol. Biol. and Evol. 2011. V. 28. № 10. P 2905- doi 10.1093/molbev/msr126
- Rootsi S., Myres N.M., Lin A.A. et al. Distinguishing the co-ancestries of haplogroup G Y-chromosomes in the populations of Europe and the Caucasus // Europ. J. Human Genet. 2012. V. 20(12) P. 1275- doi 10.1038/ejhg.2012.86
- Схаляхо Р.А. Геногеография тюркоязычных народов Кавказа: анализ изменчивости Y-хромосомы: Дис. … канд. биол. наук. М., 2013. 140 с.
- Схаляхо Р.А., Почешхова Э.А., Теучеж И.Э. и др. Тюрки Кавказа: сравнительный анализ генофондов по данным о Y-хромосоме // Вестн. Москов. ун-та. Сер. XXIII. Антропология. 2013. № 2. С. 34-49.
- Чухряева М.И., Дибирова Х.Д., Теучеж И.Э. и др. Генофонд носителей армянских и индоиранских языков в контексте индоевропейской проблематики // Матер. междунар. конф. “Языковая политика и языковые конфликты в современном мире”: Докл. и сообщ. / Отв. ред. Биткеева А.Н., Михальченко В.Ю. М.: Тезаурус. Языки народов мира, 2014. С. 579-
- Схаляхо Р.А., Почешхова Э.А., Юсупов Ю.М. и др. Спектр подходов к формированию выборок для биобанков (на примере дискуссии об анализе генофондов карачаевцев, балкарцев и ногайцев) // Матер. VII съезда Российского о-ва медицинских генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 23.
- Юсупов Ю.М., Асылгужин Р.Р., Агджоян А.Т. и др. Региональный исследовательский биобанк: принципы формирования и перспективы использования // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 50.
- Юсупов Ю.М., Асылгужин Р.Р., Дибирова Х.Д. и др. Исследование генофонда южных и северо-восточных кланов башкир // Урал и просторы Евразии сквозь века и тысячелетия. Уфа, 2013. С. 132-134.
- Хамидуллин С.И., Юсупов Ю.М., Асылгужин Р.Р. и др. История башкирских родов. Уран. Т. 7. Уфа, 2015. 268 с.
- Схаляхо Р.А., Юсупов Ю.М., Агджоян А.Т. и др. Этногенетика: игнорировать нельзя использовать // Междунар. науч. конф. “Юсуповские чтения – 2014”. Уфа, 2014. С. 217-223.
- Падюкова А.Д., Ульянова М.В., Лавряшина М.Б. и др. Проблемы формирования биобанков при обследовании изолированных популяций (на примере ясколбинских сибирских татар) // Матер. VII съезда Российского о-ва мед. генетиков. 9-23 мая 2015. Санкт-Петербург // Мед. генетика. 2015. Т. 14. № 2(152). С. 60.
- Raghavan M., Steinrücken M., Harris K. et al. Genomic evidence for the Pleistocene and recent population history of Native Americans // Science. 2015. V. 349 (6250). doi 10.1126/science.aab3884
- Балаганская О.А., Балановская Е.В., Лавряшина М.Б. и др. Полиморфизм Y хромосомы у тюркоязычного населения Алтае-Саян, Тянь-Шаня и Памира в контексте взаимодействия генофондов Западной и Восточной Евразии // Мед. генетика. 2011. Т. 10. № 3. С. 12-22.
- Балановская Е.В., Балаганская О.А., Дамба Л.Д. и др. Влияние природной среды на формирование генофонда тюркоязычного населения гор и степных предгорий Алтае-Саян, Тянь-Шаня и Памира // Вестн. Моск. ун-та. Сер. XXIII. Антропология. 2014. № 2. С. 46-55.
- Агджоян А.Т., Падюкова А.Д., Жабагин М. и др. Своеобразие генофонда сибирских татар (на примере пяти тоболо-иртышских популяций) // История и культура татар Западной Сибири. Казань: Ин-т истории им. Ш. Марджани АН РТ, 2015. С. 30-
- Агджоян А.Т., Балановская Е.В., Падюкова А.Д. и др. Генофонд сибирских татар: пять субэтносов – пять путей этногенеза // Мол. биол. 2016. Т. 50. № 6.
- Zhabagin M., Yusupov Yu., Sabitov Zh. et al. Geographical and cultural inf luences on genetic diversity: Patterns of the Y-chromosomal variation in populations with patronymic tradition // The 13th Internat. Congr. Human Genetics. 2016. April 3-7, Tue (3). P. 172.
- Сабитов Ж.М., Жабагин М.К. Этногенез казахов с точки зрения популяционной генетики // Третий конгресс историков Казахстана: Сб. научн. статей / Под общей редакцией Сыдыкова Б.Е. Астана: Изд-во ЕНУ им. Л.Н. Гумилева, 2015. С. 375-379.
- Жабагин М.К., Балановская Е.В., Сабитов Ж.М. и др. “Род” как квазигенетический маркер Y-хромосомы в популяционно-генетических и исторических исследованиях // VI Съезд ВОГиС и ассоцированные генетические симпозиумы. Ростов- на-Дону, 06/2014. С. 25-26.
- Supiyev A., Kossumov A., Utepova L. et al. Prevalence, awareness, treatment and control of arterial hypertension in Astana, Kazakhstan. A cross-sectional study // Public Health. 2015. V. 129. № 7. P. 948- doi 10.1016/j.puhe.2015.02.020
- Supiyev A., Kossumov A., Kassenova T. et al. Diabetes prevalence, awareness and treatment and their correlates in older persons in urban and rural population in the Astana region, Kazakhstan // Diabetes Research and Clinical Practice. 2016. V. 112. P. 6- doi 10.1016/j.diabres.2015.11.011
- Zhabagin M., Abilova Z., Askapuli A. et al. Vitamin D receptor gene polymorphisms in susceptibility to tuberculosis in the Kazakh population in Almaty and Almaty Area // Central Asian J. Global Health. 2013. V. 2. doi 10.5195/cajgh.2013.102
- The 1000 Genomes Project Consortium. A global reference for human genetic variation // Nature. 2015. V. 526. P. 68–74. doi 10.1038/nature15393
- Knappskog S., Gansmo L., Dibirova K. et al. Population distribution and ancestry of the cancerprotective mdm 2 snp285 (rs117039649) // Oncotarget. 2014. V. 5. № 18. P. 8223–8234. doi 10.18632/oncotarget.1910
- Наследственные болезни в популяциях человека / Под ред. Гинтера Е.К. М.: Медицина, 2002. 303 с.
- Гинтер Е.К. Медицинская генетика. М.: Медицина, 2003. 445 с.
- Балановский О.П., Кошель С.М., Запорожченко В.В. и др. Эколого-генетический мониторинг в популяциях человека: гетерозиготность, гаплотипическое разнообразие мтДНК и генетический груз // Генетика. 2011. Т. 47. № 11. С. 1523-1535.
- Рычков Ю.Г., Балановская Е.В. Концепция эколого-генетического мониторинга населения России // Успехи соврем. генетики. 1996. Вып. 20. С. 3-38.
- Pharma’s Сool – Материалы конференции. Сайт Фонда Сколково. [Электронный ресурс]. 2016. Дата обновления: 24.02.2016. URL: http:// sk.ru/events/2516.aspx
- Балановская Е.В., Нурбаев С.Д., Рычков Ю.Г. Компьютерная технология геногеографического изучения генофонда. II. Статистическая трансформация карт // Генетика. 1994. Т. 30. № 11. С. 1538-1555.
- Культин А.Ю., Стороженко И.В. Применение частот встречаемости аллелей аутосомных STR-локусов для повышения идентификационной значимости результатов исследования ДНК: Методические рекомендации. М.: ЭКЦ МВД России, 2013. 48 с.
- Чухряева М.И., Иванов И.О., Фролова С.А. и др. Программа HAPLOMATCH для сравнения STR- гаплотипов Y-хромосомы и ее применение к вопросу происхождения донских казаков // Генетика. 2016. Т. 52. № 5. С. 595-604.
Е.В. Балановская1, М.К. Жабагин2, А.Т. Агджоян1,3, М.И. Чухряева1,3, Н.В. Маркина3, О.А. Балаганская3, Р.А. Схаляхо1,3, Ю.М. Юсупов4, О.М. Утевская5, Ю.В. Богунов3, Р.Р. Асылгужин4, Д.О. Долинина6, Ж.А. Кагазежева7, Л.Д. Дамба8, В.В. Запорожченко1,3, А.Г. Романов1, Х.Д. Дибирова1,3, М.А. Кузнецова1, М.Б. Лавряшина6, Э.А. Почешхова7, О.П. Балановский1,3
1 – Медико-генетический научный центр, Москва 115478
2 – Назарбаев Университет, Астана 010017, Казахстан
3 – Институт общей генетики им. Н.И. Вавилова Российской академии наук, Москва 119991 4
4 – Институт стратегических исследований Республики Башкортостан, Уфа 450000
5 – Харьковский национальный университет им. В.Н. Каразина, кафедра генетики и цитологии, Харьков 61022, Украина
6 – Кемеровский государственный университет, кафедра генетики, Кемерово 650043
7 – Кубанский государственный медицинский университет, кафедра биологии, Краснодар 350063
8 – Научно-исследовательский институт Медико-социальных проблем и управления, Кызыл 667000